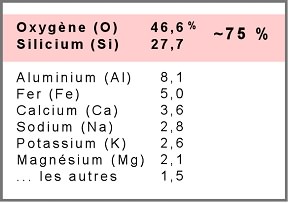
Le tableau qui suit présente la proportion des éléments chimiques les plus abondants dans la croûte terrestre.

On y voit que deux éléments seulement, Si et O, comptent pour près des trois quarts (74,3%) de l'ensemble des matériaux. Il n'est donc pas surprenant qu'un groupe de minéraux composés fondamentalement de Si et O avec un certain nombre d'autres ions et nommés silicates, compose à lui seul 95% du volume de la croûte terrestre. A noter que cette répartition n'est applicable qu'à la croûte terrestre. On considère que le noyau est composé presqu'uniquement de fer et de nickel, ce qui est bien différent de ce qu'on présente ici. Lors de la formation de la terre, les éléments légers, comme l'oxygène et le silicium ont migré vers l'extérieur, alors que les éléments plus lourds, comme le fer, se sont concentrés au centre.
Tous les silicates possèdent une structure de base composée des ions Si4+ et O2- (schéma de gauche).
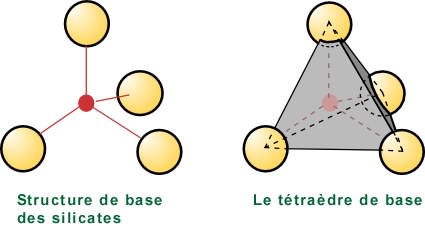
Si on relie les centres des oxygènes, on obtient un volume qui forme un tétraèdre, le tétraèdre de base (schéma de droite). Le silicium occupe le centre du tétraèdre. Le calcul des charges électriques montre qu'un tétraèdre est chargé négativement.

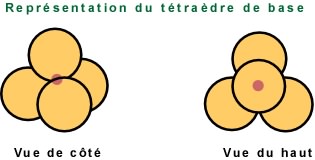
A des fins de simplification dans la construction de modèles, on représente ainsi le tétraèdre de base.
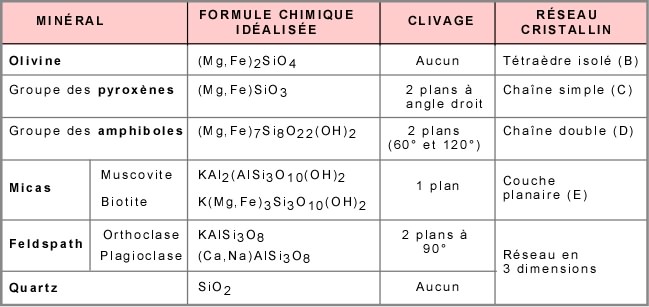
Le tableau qui suit présente les principales caractéristiques des silicates.
Dans les minéraux, les charges doivent être neutres. Il y a deux façons de neutraliser les charges: lier ensemble les tétraèdres par leurs oxygènes (liens tétraèdre à tétraèdre), ou ajouter des ions positifs, comme des fer, des magnésium, ou des potassium (liens métalliques).
Dans le cas de tétraèdres isolés, la structure est chargée à -4, comme on l'a vu plus haut dans le calcul des charges; les traits rouges illustrent ici les pôles négatifs correspondant aux 4 oxygènes.
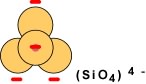
Lorsque chaque tétraèdre partage un oxygène (en bleu sur le schéma qui suit), on obtient une chaîne simple de tétraèdres. Il en résulte que pour chaque tétraèdre deux charges négatives ont été neutralisées et qu'il en reste deux autres à neutraliser (les traits rouges); la structure est chargée à -2.
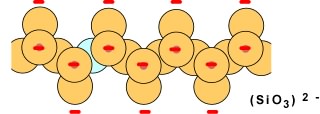
Lorsque deux chaînes simples s'unissent par leurs oxygènes (en bleu sur le schéma qui suit) pour former des chaînes doubles, on obtient une structure de formule générale Si4O11, chargée à -6.
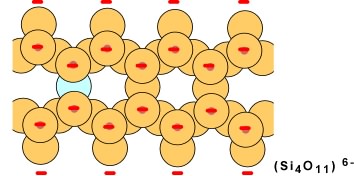
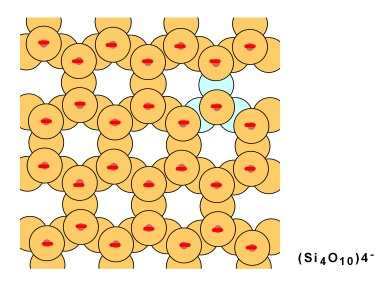
Lorsque des chaînes doubles s'unissent, chaque tétraèdre partage trois oxygènes (en bleu sur le schéma qui suit); la formule générale est Si4O10 avec une charge de -4. On aura une structure en couche.
C'est à partir de ces quatre structures de base, tétraèdre isolé, chaîne simple, chaîne double et couche, que seront formés les silicates. Les groupes des olivines, pyroxènes, amphiboles et micas seront formés par l'addition d'ions métalliques positifs comme le fer, le magnésium, le calcium, le potassium, etc., qui viendront neutraliser la structure (lien métallique).
Cas 1 : Liaisons de tétraèdres isolés par des ions métalliques : l'olivine. Plusieurs tétraèdres isolés sont unis par leurs quatre pôles négatifs grâce à des ions positifs Fe ou Mg; c'est le minéral olivine. La proportion de fer et de magnésium peut varier.
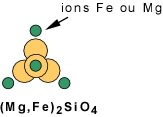
Cas 2 : Liaison de chaînes simples par des ions métalliques: les pyroxènes. Autour d'une chaîne simple, les positions disponibles pour les ions fer et magnésium se trouvent en périphérie et au sommet de la chaîne (voir plus haut). Ici encore, la proportion de fer et de magnésium est variable. La vue en bout d'une chaîne simple montre la position qu'occupent les ions fer et/ou magnésium, au sommet et en périphérie. Ces ions unissent ensemble plusieurs chaînes, montrées ici encore en bout, pour former les pyroxènes.
Les liens assurés par les ions métalliques, fer ou magnésium, sont plus faibles que les liens assurés par le partage d'oxygène entre les pôles de tétraèdres. C'est ce qui est responsable de l'existence de deux plans de faiblesses (lignes rouges) à angle droit. Ces plans de faiblesses correspondent au clivage. Les pyroxènes se caractérisent donc par deux plans de clivage, à 90° l'un de l'autre.
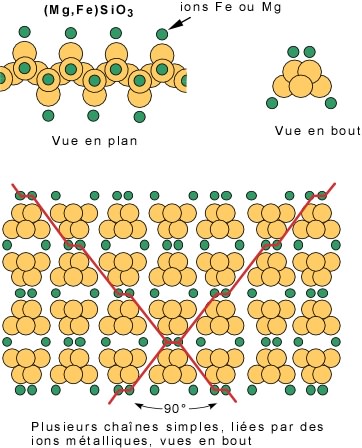
Cas 3 : Liaison de chaînes doubles par des ions métalliques: les amphiboles. Dans le cas des amphiboles, on a toujours l'unité de base silicium-oxygène, mais ici une certaine quantité d'atomes d'oxygène est remplacée par des radicaux hydroxyles (non illustrés sur le modèle). A la différence des pyroxènes, on a ici des chaînes doubles. Les positions disponibles pour les ions fer et magnésium se trouvent en périphérie et au sommet de la double chaîne (voir plus haut). La vue en bout d'une chaîne double montre la position qu'occupent les ions fer et/ou magnésium au sommet et en périphérie. Ces ions unissent plusieurs chaînes pour former les amphiboles.
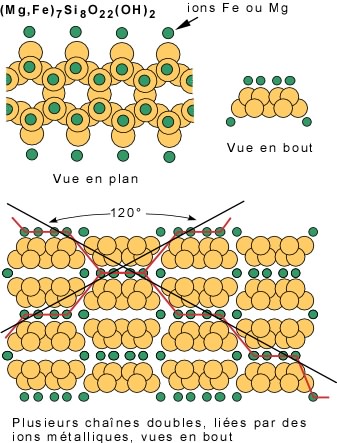
Comme dans le cas des pyroxènes, il y a des plans de faiblesses qui passent par les liens les plus faibles (lignes rouges) et qui définissent les clivages. Dans ce cas, les plans sont à 120° et le complément 60°. Les amphiboles possèdent donc deux plans de clivage, l'un à 120° et l'autre à 60°.
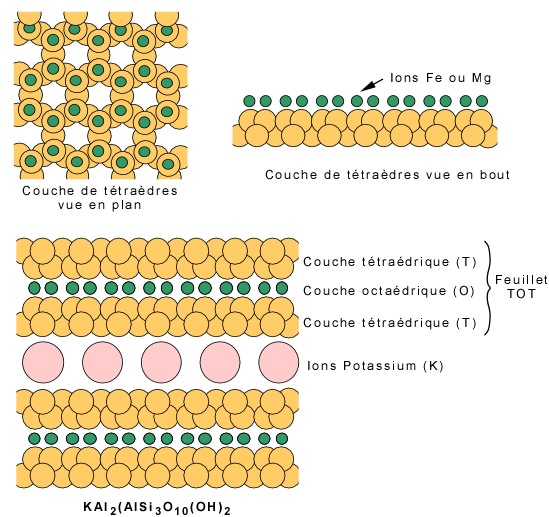
Cas 4 : Liaison de couches de tétraèdres par des ions métalliques: les micas. Dans le cas des micas, dont la structure de base est formée de couches planaires de tétraèdres, les positions disponibles pour les ions fer et magnésium se trouvent au sommet de la couche (voir plus haut), comme le montre la vue en bout d'une couche. Chez les micas il y a deux types de couches planaires: la couche tétraédrique, notée T et formée des tétraèdres silicium-oxygène (une certaine quantité d'aluminium peut se substituer au silicium), et la couche octaédrique, notée O et formée des ions Fe-Mg et des oxygènes. Ces deux types de couches forment des feuillets, lesquels sont unis par de gros ions, comme le potassium dans le cas de la muscovite, un micas commun. Les micas possèdent un plan de clivage, parallèle aux couches.
Dans le cas du quartz, il n'y a pas d'ions métalliques puisque tous les coins des tétraèdres sont liés entre eux par leurs oxygènes pour former un réseau tridimensionnel. Il n'y a pas de plans de faiblesse, donc pas de clivage.
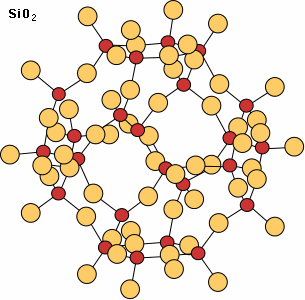
Chez les feldspaths, la structure est plus complexe. Les tétraèdres sont de deux sortes : des tétraèdres SiO4 et des tétraèdres AlO4. Ceux-ci forment un réseau tridimensionnel où les coins des tétraèdres sont liés par les oxygènes, avec des ions positifs Na, K, Ca se situant dans les interstices du réseau chargé négativement.
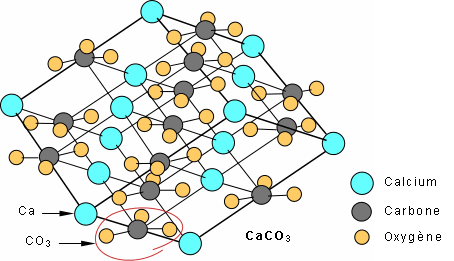
Il y a un autre groupe de minéraux qu'on retrouve fréquemment à la surface du globe, les carbonates. Ils sont un des principaux constituants des roches sédimentaires (exemple : les calcaires, ce qu'on appelle communément la pierre à chaux). Leur structure est relativement simple comparée à celle des silicates: des complexes négatifs (CO3)2-, liés par des ions positifs tels Ca, Mg, Fe. Chez la calcite, CaCO3, les (CO3)2- sont liés par des Ca2+ pour former une structure rhomboédrique typique de ce minéral.
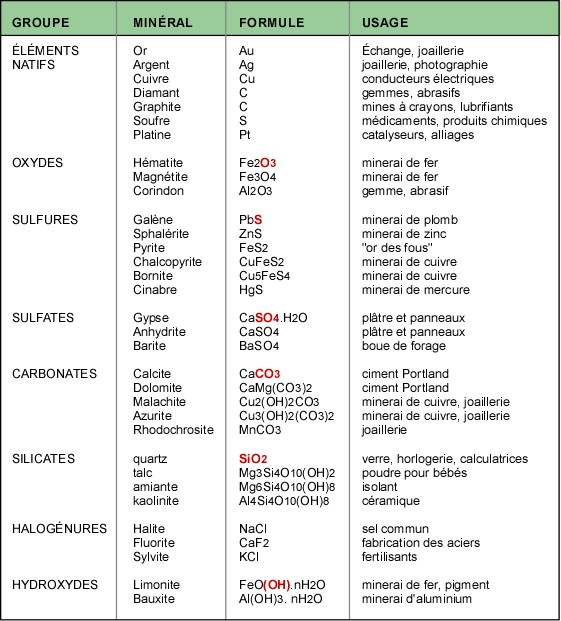
Le tableau qui suit présente les minéraux les plus communs dans les principaux groupes et leurs usages.
 | Retour au plan 2.1 |  |